Kimyacı Bilim İnsanları: Amedeo Avagadro
Merhaba sevgili inekle Blog okuyucuları, ben inekle sayısal öğretmenlerinden Kübra. Kimyacı bilimi insanları serimizin beşinci bölümüyle karşınızdayımm. Serüvenimizin bu haftaki durağı İtalyan Kimyager Amedeo Avagadro. Hadi başlayalım!
Amedeo Avagadro Kimdir?
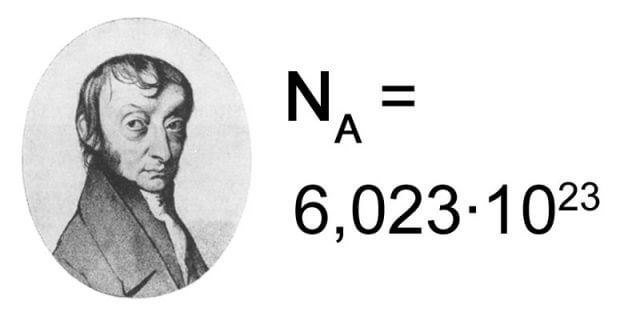
Avagadro, 9 Ağustos 1776 yılında Torino, İtalya’da köklü bir ailenin çocuğu olarak dünyaya gelmiştir. Avagadro’nun tam ismi Count Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e di Cerreto’dur. Zeki bir çocuk olan Avagadro, 20 yaşında Kilise hukuku alanında doktora derecesini almış ve dini avukat olarak çalışmaya başlamıştır. Aile yadigarı olarak avukatlığa yönelen Avagadro bir zaman sonra hukuka olan ilgisini yitirmiş ve bilime yönelmiştir. Zamanının çoğunu matematik ve fizik çalışmaya adamış ve 1803 yılında kardeşi Felice ile tuzlu çözeltilerin elektriksel davranışlarıyla ilgili ilk bilimsel makalesini yayınlamıştır. 1820’de Avogadro, Torino Üniversitesi’nde matematiksel fizik profesörü olmuş, ancak bu görev siyasi kargaşa nedeniyle kısa sürmüş ve Avogadro 1823’te işini kaybetmiştir. 1833’te yeniden atanmış ve 74 yaşında 1850’de emekli olana kadar bu görevde kalmıştır.
Bir Aristokrat olmasına rağmen oldukça mütevazı ve sessiz bir hayat yaşamıştır.1818’de Felicita Mazzé ile evlenmiş ve altı çocukları olmuştur. Avagadro 9 Temmuz 1856 da Turin, İtalya’da hayata gözlerini yummuştur.
Amedeo Avagadro Çalışmaları
Avagadro’nun günümüze oldukça katkı sağlayan ve kimya derslerinde sıklıkla karşı karşıya geldiğimiz iki önemli çalışması bulunmaktadır.
1. Avagadro Sayısı

Bir elementin bir molündeki atom sayısı veya bir bileşiğin bir molündeki molekül sayısıdır. Avogadro Sabiti olarak da bilinir. Mol, karbon-12 atomlarının 12 gramındaki atomların sayısı kadar tanecik içeren bir sistemdeki tanecik sayısı olarak tanımlanıyordu. Yeni tanıma göre ise mol, Uluslararası Birimler Sistemi’nde (SI) madde miktarının birimidir ve tam olarak 6,02214076*1023 sayıda temel tanecik içerir.[3] Bu sayı Avogadro sabitinin (NA) sayısal değeridir.
Dünya Mol Günü, her sene 23 Ekim’de saat 6:02 ile 18:02 arasında kutlanıyor, çünkü ay-tarih biçiminde yazıldığında, tarih ve saat, 6,02*1023 Avogadro’nun rakamlarını içeriyor.
2. Avagadro Yasası
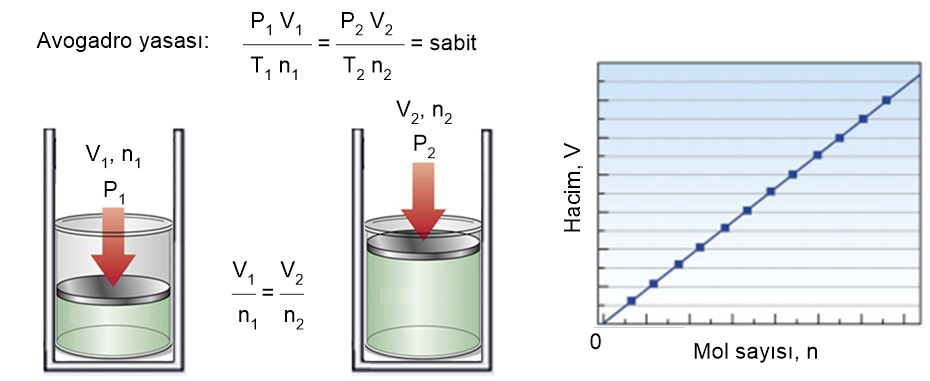
Avagadro’nun 1811 yılında bulduğu bu gaz yasası, eşit hacimdeki gazların; eşit sıcaklık ve eşit basınçta aynı sayıda parçacık ya da molekül sayısına sahip olduğunu öne sürer. Buna göre, belirli bir hacimdeki gazın bulundurduğu molekül sayısı, gazın kütle ya da boyutundan bağımsızdır. Örnek olarak, aynı hacimdeki hidrojen ve nitrojen verilebilir. Buna göre, hidrojen de nitrojen de aynı hacim, aynı basınç ve aynı sıcaklıkta aynı molekül sayısına sahiptir.
Bir serüvenin daha sonuna geldik sevgili okur. Başka yazılarda görüşmek üzere. Kendine iyi bak, inekle ile kal. <3 😊
Kübranur Aktan

07.03.2023