Elektron Konfürgasyonu Üzerine
Merhaba sevgili inekle Blog Okurları, ben sayısal öğretmenlerinden Sıla. Kimya Mühendisliği ikinci sınıf öğrencisiyim. Bugün sizinle elektron konfürgasyonu hakkında konuşacağız. Hadi başlayalım:
Elektron dizilimi, ilk olarak Bohr atom modeline göre tasarlanmıştır. Günümüzdeki elektron dizilimi, Bohr atom modelinden biraz farklıdır. Daha sonraki yıllarda Pauli’nin bu modeli yeniden inceledi; dördüncü kuantum sayısına ve Dışlama ilkesini buldu. Schrödinger denklemi ise orbitallerin nasıl oluştuğu bilgisi ve elektronların orbitallere nasıl yerleştiği konusunda bilgi verdi.
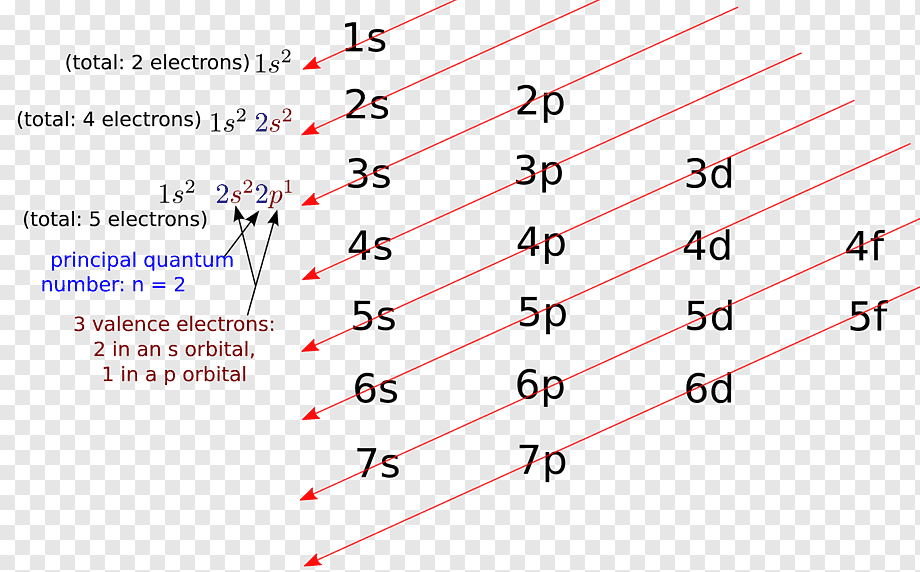
Bizim lisede kimya dersinde ezberlediğimiz 1s22s22p63s23p64s23d10 ifadesine biraz yakından bakalım:
- ‘’s,p,d,f’’ alt kabukların baş harfleridir. Sharp(keskin), Principle(asıl), Diffuse(yayılmış), Fundamental(temel)
s alt kabuğunda 1 orbital, p alt kabuğunda 3 orbital, d alt kabuğunda 5 orbital, f alt kabuğunda 7 orbital vardır. Her orbitalde en fazla iki elektron bulunabilir. Şimdi neden bir orbitalde en fazla iki elektron bulunabileceğine bakalım:
Bunun sebebi Pauli’nin Dışlanma İlkesi ile açıklanmıştır. Kısaca şöyle açıklayabiliriz. Spin kuantum sayısı en fazla iki değerlik alabilir (-1/2 ve 1/2) bu durumda : orbitalde hiç elektron olmayabilir, bir elektron olabilir, iki elektron olabilir. Ama ikiden fazla elektron bulunamaz.
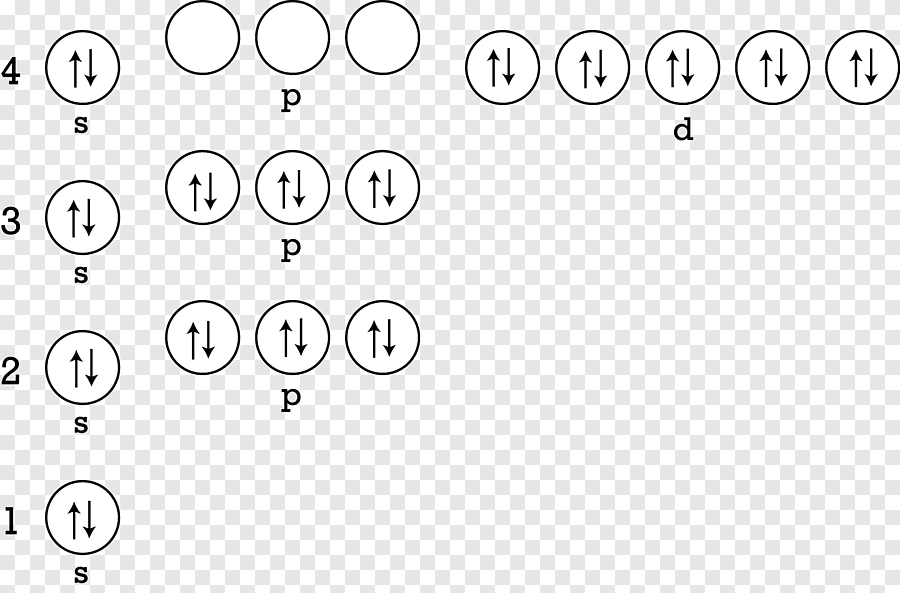
Şimdi ataomun kuantum tanımına yakından bakalım:
1. Baş Kuantum Sayısı(n): Elektronun çekirdeğe olan uzaklığını gösterir, baş kunatum sayısı ne kadar büyükse elektron çekirdeğe o kadar uzaktır, mesela n=3 olan bir elektron 3.enerji seviyesindedir.
2. Açısal Kuantum Sayısı(l): Elektron bulutlarının şekillerini gösterir.
Açısal Momentum(l) | 0 | 1 | 2 | 3 |
| Orbital Sembolü | s | p | d | f |
3. Manyetik Kuantum Sayısı(Ml): orbitallerin uzaydaki yönelim biçimlerini gösterir.
S orbitali için ml =0 d orbitali için ml = -2,-1,0,1,2
P orbitali için ml=-1,0,1 f orbitali için ml=-3,-2,-1,0,1,2,3
4.Spin Kuantum Sayısı: Elektronun kendi etrafında dönmesine ‘’spin hareketi’’ denir. Elektronun davranışını spin kuantum sayısı belirler bu ya negatif ya pozitif yöndedir ve mutlak değeri ½ ‘dir.
Evet arkadaşlar bugün lisede öğrendiğimiz atomun kuantum modeli konusuna daha detaylı ve neyin nereden geldiğini göstererek bakmaya çalıştık. Yeni yazılarda görüşmek üzere!
Sevgiyle kalın.
Sıla Subaşı

29.04.2024